Bauchwandhernien
Die primären (Nabelhernien, epigastrische Hernien) und sekundären (Narbenhernien) Bauchwandhernien sind unter den häufigsten Operationsindikationen in der Allgemein- und Viszeralchirurgie. Im Jahr 2018 wurden in Deutschland 60.566 Nabelhernien, 49.387 Narbenhernien und 10.695 epigastrische Hernien stationär behandelt [1]. Trotz der Häufigkeit dieser Eingriffe wird die evidenzbasierte Datenlage für spezifische Therapieentscheidungen in den Leitlinien als unzureichend angesehen [2, 3, 4, 5, 6].
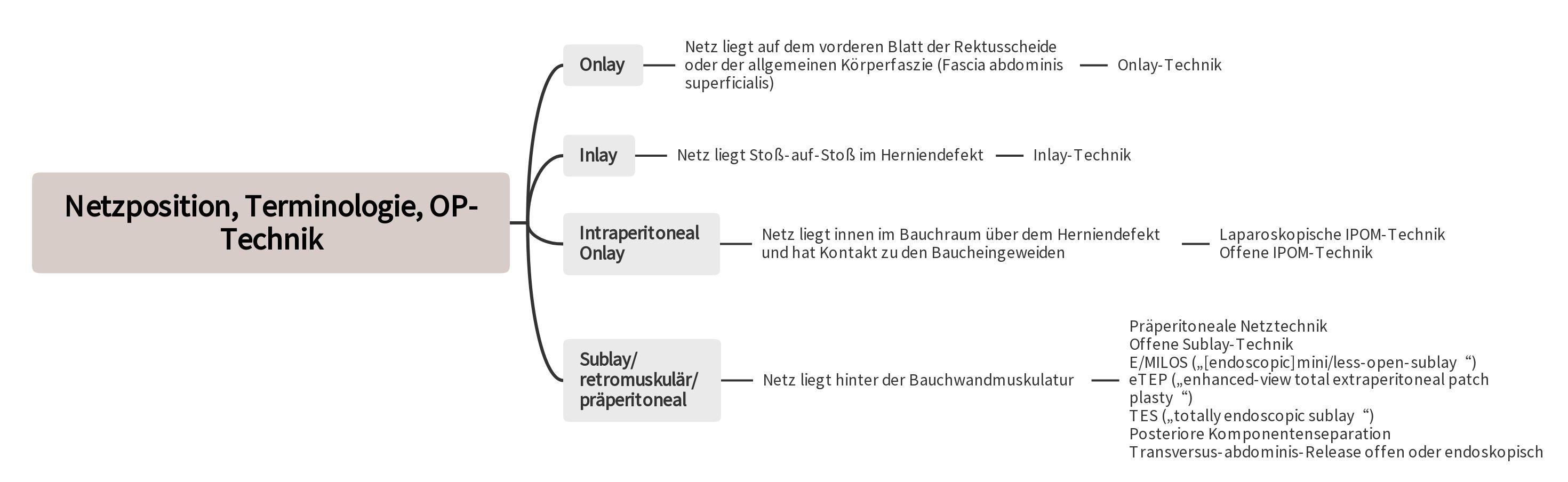
Die Verwendung von Netztechniken stellt den Standard in der Behandlung von Bauchwandhernien dar[2, 3, 4, 5, 6]. Insbesondere wird die retromuskuläre Positionierung des Netzes hinter der Bauchwandmuskulatur und außerhalb des Bauchraums als bevorzugt angesehen [2, 3, 4, 5, 6].
Um die hohe Rate an Wundkomplikationen bei offenen Operationen zu reduzieren und potenzielle Risiken des Netzkontakts mit den Baucheingeweiden bei der IPOM-Technik zu vermeiden, wurden verschiedene innovative Techniken entwickelt [3, 4, 6]. Diese neuen Ansätze zeichnen sich durch die Platzierung des Netzes über kleine Inzisionen oder endoskopisch in die Sublay /retromuskuläre/präperitoneale Schicht aus.
Klassifikation der Bauchwandhernien
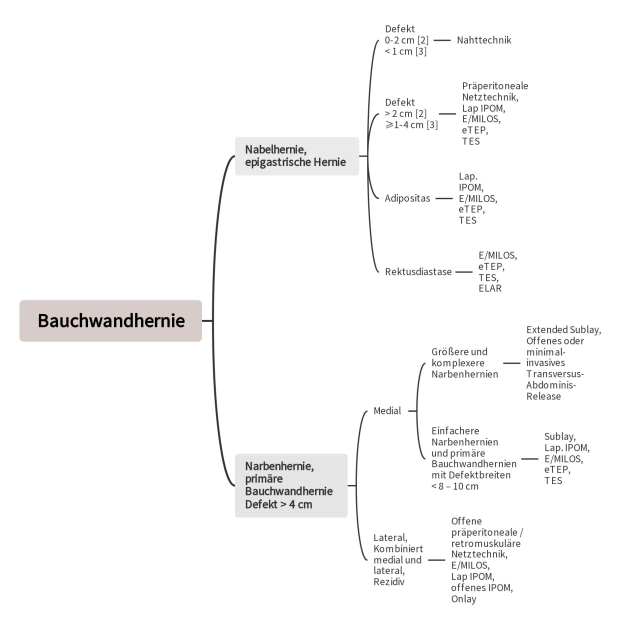
Die European Hernia Society hat eine Klassifikation für primäre und sekundäre Bauchwandhernien entwickelt [7]. In Bezug auf ihren Defektdurchmesser werden primäre Bauchwandhernien wie Nabelhernien und epigastrische Hernien in klein (< 2 cm), mittel (≥ 2–4 cm) und groß (> 4 cm) klassifiziert. Allerdings ist diese simple Klassifizierung bei primären Bauchwandhernien in der Mittellinie problematisch, vor allem bei gleichzeitigem Vorliegen einer Rektusdiastase. In diesen Situationen ist es ratsam, Breite und Länge der Rektusdiastase zu ermitteln und zu berücksichtigen [8].
Die Klassifikation der sekundären Bauchwandhernien (Narbenhernien) orientiert sich zunächst an der medialen und lateralen Defektlokalisation in der Bauchwand. [7]). Die Defektlokalisation medialer Narbenhernien wird sodann mit den Angaben subxiphoidal, epigastrisch, umbilikal, infraumbilikal und suprapubisch genauer eingegrenzt. Bei den lateralen Defekten wird zwischen subkostal, seitlich, iliakal und lumbal unterschieden. Da die Defektbreite einen ungünstigen Einfluss auf das postoperative Ergebnis bei der Versorgung von Narbenhernien hat, wird diese bei der Klassifikation besonders berücksichtigt. Je nach Defektbreite variieren die Narbenhernien in W1 (< 4 cm), W2 (≥ 4–10 cm) und W3 (> 10 cm) [7]. Existieren mehrere Herniendefekte („Swiss-cheese“-Hernie), werden diese bei der Messung der Länge und Breite des Defektes zusammengefasst. Aufgrund schlechterer Ergebnisse werden Rezidivnarbenhernien, die ungefähr 25 % des Gesamtaufkommens an Narbenhernien ausmachen, separat klassifiziert [7, 9, 10].
Diagnostik
Bei der Diagnose von Bauchwandhernien werden neben klinischen Untersuchungen auch Ultraschall, Magnetresonanztomographie (MRT) und Computertomographie (CT) verwendet [11]. Ein systematisches Review zur Narbenhernien-Diagnostik kommt zu dem Ergebnis, dass die Prävalenz der Narbenhernie steigt, wenn andere diagnostische Methoden im Vergleich zur rein klinischen Untersuchung angewendet werden [13]. Wenn man die unterschiedlichen diagnostischen Methoden miteinander vergleicht, liefert die CT-Untersuchung die verlässlichsten Resultate [11].
Bauchwandhernien gelten bei Defektbreiten von mehr als 10 cm als komplexe Hernien [12]. Eine präoperative CT- oder MRT-Untersuchung wird bei diesen Patienten zunehmend zur Planung der operativen Taktik und Risiko-Abschätzung gefordert, da in der Regel eine Komponentenseparation erforderlich ist , über deren erhöhte Komplikationsrate die Patienten präoperativ aufgeklärt werden müssen[13, 15]. Eine CT- oder MRT-Untersuchung liefert auch Hinweise über den Zustand der Bauchwandmuskulatur, was für die Planung des passenden Rekonstruktionsverfahrens mitentscheidend ist [13].
Tailored Approach
Zur Therapie von Bauchwandhernien ab einer Defektgröße von ≥ 2 cm wird eine Netztechnik empfohlen [2]. Die Richtlinien der European Hernia Society und der American Hernia Society weisen darauf hin, dass der Einsatz eines Netzes bei epigastrischen und Nabelhernien bereits bei einem Durchmesser von ≥ 1 cm indiziert ist [3]. Ein Nahtverfahren sollte nur bei Defekten von < 1 cm angewendet werden [3].
Aufgrund der unterschiedlichen Empfehlungen existiert ein Ermessensspielraum bei Defekten von 1 bis 2 cm. Bei primären Bauchwandhernien sollte zumindest ab einem Defektdurchmesser von über 2 cm ein Netzverfahren angewendet werden [2, 3]. Eine präperitoneale Netztechnik wird in den Leitlinien der American Hernia Society und der European Hernia Society für Defekte bis 4 cm empfohlen, allerdings besteht auch die Möglichkeit den Defekt mittels der minimal-invasiven Sublay-Techniken E/MILOS, eTEP oder TES zu versorgen.
Die vorgenannten Empfehlungen gelten in erster Linie für Patienten ohne Adipositas (Body-Mass-Index [BMI] < 30 kg/m²) und/oder Rektusdiastase sowie Defekten bis 4 cm Durchmesser. Aktuelle Untersuchungen zeigen, dass bei Adipositas das laparoskopische IPOM im Vergleich zu den offenen Verfahren bei Bauchwandhernien eine niedrigere Wundkomplikationsrate aufweist [5, 6]. Daher sollten bei Adipositas vornehmlich minimal-invasive Techniken angewendet werden [5, 6]. Neuen Techniken wie E/MILOS, eTEP und TES kann zur Vermeidung der Risiken der intraabdominellen Netzplatzierung Vorrang gegeben werden, obwohl es bisher noch keine vergleichenden Studien gibt.
Bei einer primären Bauchwandhernie mit gleichzeitiger Rektusdiastase sind präperitoneale Netztechnik und laparoskopisches IPOM nicht ausreichend [4, 5, 6]. Hier bieten sich die neuen minimal-invasiven Techniken an, bei denen das Netz in der Sublay-Schicht platziert wird [4, 5, 6]. Alternativ können die medialen Anteile der beiden vorderen Blätter der Rektusscheiden verwendet werden, um die Linea alba anatomisch zu rekonstruieren und den Defekt zu verschließen. Bei der Endoscopic-assisted-Linea-alba-Reconstruction (ELAR) wird das Netz ausschließlich zur Augmentation verwendet [14].
Bei Defekten > 4 cm sollte wie bei Narbenhernien vorgegangen werden. Nach lateralen, kombiniert lateralen und medialen Inzisionen sowie nach vorangegangenen Narbenhernienreparationen mit Netzen sind Sublay-Techniken wegen der erheblichen narbigen Veränderungen der extraperitonealen/retromuskulären Schicht meist nicht möglich.
Mögliche Risikomarker für ungünstige Resultate
Eine Analyse zeigt, dass Nahttechniken bei Nabelhernien mit einem Durchmesser von weniger als 2 cm im Vergleich zu Netztechniken eine deutlich höhere Rezidivrate aufweisen [15]. Auch das weibliche Geschlecht ist mit einem höheren Rezidivrisiko verbunden [15]. Die Nahttechniken weisen allerdings geringere postoperative Komplikationen auf. Obwohl das laparoskopische IPOM ein geringeres Risiko für postoperative Komplikationen bei kleinen (< 2 cm) Nabelhernien aufweist, sind intraoperative Komplikationen, Rezidive, chronische Schmerzen und allgemeine Komplikationen häufiger [15].
Bei der Nabelhernie mit größeren Defektbreiten und offenen Eingriffen muss mit mehr postoperativen Komplikationen, komplikationsbedingten Reoperationen und allgemeinen Komplikationen gerechnet werden [16]. Das Risiko für Ruhe- und belastungsabhängige Schmerzen sowie chronische therapiebedürftige Schmerzen im 1-Jahres-Follow-up ist bei Frauen und bereits präoperativ bestehenden Schmerzen erhöht [16, 17]. Eine erhöhte Defektbreite, ein gesteigerter BMI und eine seitliche Defektlokalisation führen zu signifikant mehr Rezidiven [16].
Technische Aspekte
1. Operationstechniken bei primären Bauchwandhernien
1.1 Nahttechnik
Für die Durchführung der Nahttechnik bei Nabel- und epigastrischen Hernien mit Defekten von weniger als einem Zentimeter wird schnellresorbierbares Nahtmaterial nicht empfohlen. Allerdings gibt es in der Fachliteratur nur eine begrenzte Evidenz für langsam resorbierbares und nichtresorbierbares Nahtmaterial [3]. Sowohl eine fortlaufende als auch eine Einzelkopfnahttechnik können angewendet werden. Der Defektverschluss sollte Stoß-auf-Stoß erfolgen.
1.2 Präperitoneale Netztechnik
Gemäß den Richtlinien der European Hernia Society und der American Hernia Society wird bei Nabel- und epigastrischen Hernien mit Defekten von ≥ 1–4 cm ohne Rektusdiastase die präperitoneale Netztechnik empfohlen [3]. Dabei soll eine Defekterweiterung zwecks Vereinfachung der Netzplazierung vermieden werden. Um einen direkten Kontakt der Baucheingeweide mit dem Netz zu verhindern, werden Teile des Bruchsacks zum Verschluss der peritonealen Lücke verwendet. Das nichtresorbierbare Netz (meist rund) sollte den Defekt auf allen Seiten um 3 cm überlappen, entsprechend muss das Peritoneum auf allen Seiten um den Defekt herum von der Bauchwand abpräpariert werden. Die Fixation des Netzes erfolgt mittels nichtresorbierbarer Nähte. Danach wird der Fasziendefekt über dem Netz mit langsam oder nichtresorbierbaren Nähten geschlossen.
2. Operationstechniken bei primären und sekundären Bauchwandhernien
2.1 Laparoskopische intraperitoneale Onlay-Mesh-Technik
Nach den Richtlinien der European Hernia Society und der American Hernia Society wird die laparoskopische IPOM-Technik für größere primäre Bauchwandhernien und bei Patienten mit einem erhöhten Risiko für Wundkomplikationen empfohlen [3]. Dies betrifft insbesondere Patienten mit Adipositas (Body-Mass-Index ≥ 30 kg/m²) und Patienten mit einer Defektgröße von über 4 cm [3]. Bei Narbenhernien sollte der Defekt eine Größe von nicht mehr als 8-10 cm aufweisen [5, 6]. Bei Anwendung der laparoskopischen IPOM-Technik sollte stets ein Defektverschluss angestrebt werden [3, 5, 6]. Dadurch werden die Seromrate reduziert, eine verbleibende Vorwölbung der Bauchwand vermieden und Rezidive minimiert [3, 5, 6]. Das Netz muss den Defekt allseitig mindestens 5 cm überlappen [3, 5, 6]. Die Fixierung des Netzes erfolgt mittels Tacker und Nähten [3, 5, 6].
2.2 Minimalinvasive Sublay-Techniken E/MILOS, eTEP und TES
Die minimalinvasiven Sublay-Techniken bieten bei primären Bauchwandhernien eine Alternative zur präperitonealen Netztechnik und zum laparoskopischen IPOM, insbesondere in Verbindung mit Adipositas und/oder Rektusdiastase. Bei Narbenhernien stellen sie eine Alternative zur offenen Sublay-Operation und zum laparoskopischen IPOM dar, wenn Defekte von 8-10 cm vorliegen.
2.2.1 E/MILOS ([endoscopic] mini/less open sublay)
Die E/MILOS-Operation ist ein minimal-invasives Hybrid-Verfahren, das die Einlage großer Kunststoffnetze in die mediale und laterale Bauchwand ermöglicht. Die Operation beginnt in einer mini-offenen Technik mit Inzisionen von bis zu 5 cm ("mini-open"), ggf. 6-12 cm ("less open") [18, 19]. Die Präparation erfolgt sodann transhernial entweder mit lichtarmierten laparoskopischen Instrumenten unter direkter Sicht oder mit gasloser Endoskopie. Nach dem Einsatz eines Monoports oder eines gasdicht blockierbaren Optiktrokars kann die MILOS-Operation endoskopisch durchgeführt werden [18, 19].
Nach klassischer Präparation des Bruchsackes und der Faszienränder wird der Bruchsack eröffnet, der Inhalt identifiziert ,reponiert oder reseziert. Intraabdominelle Adhäsionen können über den Herniendefekt entweder offen oder laparoskopisch gelöst werden. Nach ggf. Resektion überschüssiger Bruchsackanteile wird das Peritoneum verschlossen und es erfolgt die streng extraperitoneale stumpfe Präparation der retromuskulären Schicht. Bei kompletter Präparation des medialen Kompartiments können Standardkunststoffnetze bis zu einer maximalen Größe von ca. 40 × 20 cm plan auf dem Netzlager platziert werden. Aufgrund der Defekt-Überlappung des Netzes von mindestens 5 cm kann in der Regel auf eine Fixierung verzichtet werden [4]. Bei der MILOS-Operation ist auch eine posteriore Komponentenseparation möglich. Riesenhernien mit „loss of domain“ sind nicht für die MILOS Technik geeignet.
2.2.2 eTEP („extended totally extraperitoneal“)
Die eTEP-Technik basiert auf den Erfahrungen mit der total extraperitonealen Patchplastik (TEP) bei der Behandlung von Leistenhernien [20]. Bei Hernien am und oberhalb des Nabels wird der erste Zugang im Bereich der rechten Rektusscheide einige Zentimeter unterhalb des Nabels gewählt [20]. Nach Darstellung des vorderen Blattes der rechten Rektusscheide wird diese eröffnet, der Rektusmuskel lateralisiert, anschließend ein Ballontrokar extraperitoneal eingeführt und hier ein entsprechender Raum aufdilatiert. Nach dem Einbringen eines gasdichten Optiktrokars und Insufflation von CO2-Gas können dann unter Sicht zwei Arbeitstrokare oberhalb der Symphyse platziert werden. Nachfolgend erfolgt eine Änderung der Arbeitsrichtung, bei der beide hinteren Blätter der Rektusscheiden am medialen Rand abgetrennt werden, wodurch beide retrorektale Räume miteinander verbunden werden [20].
Im Bereich des Nabels oder proximal davon stößt man auf den Bruchsack. Dieser wird am Rand eröffnet, der Inhalt wird reponiert oder reseziert. Danach werden die beiden hinteren Blätter der Rektusscheiden oberhalb der Bruchlücke medial bis zum Xiphoid abgesetzt. Durch den Nahtverschluss des Defekts im Bereich der Hernie entsteht der gleiche retrorektale Raum wie bei der E/MILOS-Operation. Auf das Netzlager bestehend aus den hinteren Blättern der Rektusscheide, dem Peritoneum und der Fascia transversalis kann dann ein ausreichend großes Netz platziert werden [20]. Bezüglich der eTEP-Technik existieren diverse Modifikationen hinsichtlich der Zugänge bzw. Positionierung der Trokare [21].
2.2.3 TES (Totally-endoscopic-Sublay-Technik)
Die TES-Technik unterscheidet sich von der eTEP-Methode lediglich darin, dass der Extraperitonealraum nicht durch einen Optiktrokar in der rechten Rektusscheide unterhalb des Nabels geschaffen wird, sondern über einen Optiktrokar direkt oberhalb der Symphyse und durch Schaffung des Extraperitonealraums mittels stumpfer Präparation. Sobald der Extraperitonealraum eröffnet ist, können unter Sicht zwei Arbeitstrokare eingeführt werden [22]. Die weiteren Schritte der Präparation und Netzeinbringung erfolgen dann entsprechend der eTEP-Methode [22].
3. ELAR (Endoskopisch assistierte Linea-alba-Rekonstruktion)
Insbesondere bei jungen, schlanken Frauen nach Geburten kann die endoskopisch assistierte Linea-alba-Rekonstruktion als Therapiealternative zur Behandlung primärer Bauchwandhernien mit gleichzeitig bestehender Rektusdiastase betrachtet werden [4, 8, 14, 23].
Bei dieser Methode erfolgt eine bogenförmige Hautinzision mit Linksumschneidung des Nabels, die bis zu 2 cm nach proximal in der Mittellinie fortgesetzt wird. Ähnlich wie bei der E/MILOS-Operation zur Reparation symptomatischer Nabel- und epigastrischer Hernien erfolgt sodann die klassische Behandlung des Bruchsacks. Nach Abpräparieren des Nabels von der Bauchwandfaszie wird der mediale Teil der beiden vorderen Blätter der Rektusscheide im Bereich der Rektusdiastase freipräpariert. Die Präparation erfolgt nach proximal und distal vom Nabel aus bis der Abstand zwischen den beiden Rektusmuskeln nur noch 2 cm beträgt, was je nach Befund ggf. bis zum Xiphoid und bis weit unterhalb des Nabels erforderlich sein kann. Die Präparation über die Hautinzision hinaus erfordert den Einsatz einer videoendoskopischen Kamera mit Lichtquelle.
Im Anschluss wird das vordere Blatt der Rektusscheiden etwa 1-2 cm vom medialen Rand entfernt inzidiert und die beiden medialen Anteile der vorderen Blätter der Rektusscheiden in der Mittellinie mit einer fortlaufenden, nichtresorbierbaren Naht adaptiert. Dadurch entsteht eine neue Linea alba, die Defekte werden verschlossen und die Rektusmuskulatur wandert zurück zur Mittellinie. Zur vollständigen anatomischen Rekonstruktion wird ein Netz als Ersatz für das vordere Blatt der Rektusscheiden in den Defekt eingenäht. Diese Methode wird als die einfachste Technik der Komponentenseparation angesehen und wird auch ohne zusätzliche Netzverstärkung als "myofasziales Release" in der plastischen Chirurgie durchgeführt [14, 23].
4. Operationstechniken bei sekundären Bauchwandhernien
Bislang waren das laparoskopische IPOM und die Sublay-Technik bei einer einfachen Narbenhernie mit einer Defektbreite von < 8–10 cm die üblichen Operationstechniken [5,6]. Das laparoskopische IPOM wird aufgrund der möglichen Gefahren einer intraabdominellen Netzplatzierung immer mehr durch minimal-invasive Sublay-Techniken ersetzt [24]. Dies führte zur Entstehung des „tailored retromuscular approach“, was bedeutet, dass die verschiedenen retromuskulären Techniken (E/MILOS, eTEP und TES, Sublay, posteriore Komponentenseparation/Transversus-abdominis-release abhängig von Defektbreite und individuellen Patienten-Eigenheiten eingesetzt werden.
Die grundlegenden Techniken von E/MILOS, eTEP, TES und laparoskopischem IPOM wurden bereits bei den primären Bauchwandhernien vorgestellt. Dass Narbenhernien mittels E/MILOS-Technik effizient versorgt werden können, konnte bereits im Vergleich mit der offenen Sublay-Operation und dem laparoskopischen IPOM nachgewiesen werden [19].
4.1 Offene Sublay-Technik
Die Sublay-Technik beschreibt eine retromuskuläre präperitoneale Position des Netzes, die im Idealfall eine Mittellinienrekonstruktion mit Verschluss der Faszie über dem Netz beinhaltet. Auf dem hinteren Blatt der Rektusscheide und der Fascia transversalis wird das Netz unter den M. rectus abdominis implantiert [24]. Ein gutes Netzwiderlager mit ausreichender Durchblutung und ein niedrigeres Infektionsrisiko sind die Gründe für die Vorzüge dieser Technik. Der intraabdominelle Druck lastet bei diesem Operationsverfahren auf dem Netz als stärkster Komponente des Verschlusses und unterstützt dessen Fixation. Dadurch kann eine niedrige Rezidivrate erreicht werden [25, 26].
4.2 Posteriore Komponentenseparation/Transversus-abdominis-Release
Die ersten Schritte des Transversus-abdominis-Release ähneln der Sublay-Technik. Daher kann die Sublay-Operation intraoperativ zum Transversus-abdominis-Release erweitert werden, wenn bei größeren Defekten die Absetzung der hinteren Blätter der Rektusscheiden mangels ausreichend großen Netzlagers für einen Defektverschluss nicht ausreicht. Die differenzialtherapeutischen Überlegungen müssen bei Narbenhernien in der Mittellinie mit einer Defektbreite von ≥ 10 cm das Transversus-abdominis-Release berücksichtigen. Eine präoperative Computertomographie ist dabei sehr nützlich.
Mit dem Absetzen der beiden hinteren Blätter der Rektusscheide vom Xiphoid bis hinab zur Linea arcuata ist der Sublay-Teil des Transversus-abdominis-Release beendet. Der Raum zwischen Xiphoid und „fatty triangle“ ist kranial eröffnet und der präperitoneale Raum zwischen Rektusmuskeln und Fascia transversalis/Peritoneum bzw. Symphyse und Blase kaudal zugänglich. Damit steht ein extraperitoneales Netzlager zur Verfügung, auf das Netze von 30 x 30 cm und größer eingebracht werden können.
Nach ersten Publikationen ist es auch möglich, die offene Transversus-abdominis-Release-Technik als Ergänzung zur eTEP, E/Milos oder roboterassistiert anzuwenden [3, 27].
4.3 Offenes IPOM
Eine extraperitoneale oder retromuskuläre Netzplatzierung ist bei Narbenhernien nach queren, lateralen und kombiniert medial-lateralen Inzisionen sowie bei Rezidiven infolge ausgeprägter Vernarbungen meist nicht möglich [27]. In diesen Fällen ist die offene IPOM-Technik die einzige Therapieoption [27]. Im Vergleich zur Sublay-Technik führt die offene IPOM-Technik im 1-Jahres-Follow-up zu mehr chronischen Schmerzen [28]. In der Literatur gibt es für das offene IPOM einen beträchtlichen Unterschied bei den postoperativen Komplikations- und Rezidivraten. Eine breite Überlappung des Netzes, die Vermeidung der Präparation in der Bauchwand und ein Defektverschluss sind erforderlich, um mit dem offenen IPOM bessere Resultate zu erzielen [27]. Es ist auch möglich, Teile des Bruchsackes als Defektverschluss zu verwenden [27].
4.4 Offenes Onlay
Eine Studie ergab, dass die Onlay-Technik im Vergleich zur Sublay-Technik eine vergleichsweise hohe Rate postoperativer Komplikationen aufweist [29]. Eine Untersuchung des Herniamed-Registers zeigte, dass es keine wesentlichen Unterschiede in den Resultaten bei kleinen und lateralen Narbenhernien zwischen Sublay- und Onlay-Techniken gab [30].
Ein ausreichendes Überlappen des Netzes (mindestens 5 cm) und ein Defektverschluss führen auch beim offenen Onlay zu günstigeren Resultaten. Es ist auch möglich, einen gedoppelten Bruchsack für den Defektverschluss zu nutzen. Postoperativ sollten eine Drainage und evtl. auch Bauchbinden verwendet werden, da Serome bei einem offenen Onlay vermehrt vorkommen [29].
Robotisch-assistierte Chirurgie ventraler Bauchwandhernien
Die Entwicklung robotisch-assistierter retromuskulärer Verfahren hat in der Chirurgie ventraler Bauchwandhernien bedeutende Fortschritte ermöglicht. Mit der Verfügbarkeit von Robotern können Eingriffe mit retromuskulärer Netzplatzierung nun auch vollständig minimal-invasiv durchgeführt werden.
Im Jahr 2018 haben Muysoms et al. und Belyansky et al. robotische Modifikationen von minimal-invasiven Operationsverfahren mit retromuskulärer Netzverstärkung für eine vollständig minimal-invasive Behandlung von Bauchwandhernien beschrieben [31, 32]. Während Muysoms eine roboterunterstützte transabdominale Reparatur von Nabelhernien mit retromuskulärer Technik (robotisch-transabdominelle retromuskuläre umbilikale Patchplastik, r-TARUP) beschrieb, favorisierte Belyansky einen extraperitonealen Zugang für eine robotische "enhanced view totally extraperitoneal plasty" („enhanced view totally extraperitoneal plasty, r-eTEP). Mithilfe der Robotik ist auch das in der offenen Chirurgie etablierte Transversus-abdominis-release minimal-invasiv möglich [33].
Bisher gibt es nur abgeschlossene randomisierte kontrollierte Studien mit längerfristigem Follow-up zur robotischen IPOM-Netzpositionierung. In einer Multicenterstudie von Dhanani et al. wurden 124 Patienten randomisiert, von denen 101 das 2-Jahres-Follow-up abgeschlossen haben [34]. Während in der ersten Veröffentlichung keine signifikanten Unterschiede im perioperativen Verlauf festgestellt wurden, zeigten sich nun in der Analyse der 2-Jahres-Ergebnisse erste Vorteile der robotischen Technik mit einer niedrigeren Rezidivrate und einer signifikant geringeren Reoperationsrate [34, 35]. Für retromuskuläre Verfahren liegen derzeit nur systematische Reviews und Metaanalysen zum perioperativen Verlauf vor, Untersuchungen mit einem längeren Follow-up fehlen.
Im Jahr 2021 veröffentlichten Bracale et al. eine Metaanalyse, die Studien einschloss, die bis September 2020 veröffentlicht wurden und den offenen und robotischen Transversus-abdominis-release verglichen [36]. In dieser systematischen Überprüfung zeigte sich in der robotischen Gruppe eine deutlich niedrigere Gesamtkomplikationsrate, ein signifikant verkürzter stationärer Aufenthalt und eine signifikant längere Operationsdauer. Ein statistisch signifikanter Unterschied in der Wundinfektionsrate wurde nicht festgestellt.
Im Jahr 2022 veröffentlichten Dewulf et al. eine Fallbeobachtungsstudie aus zwei europäischen Hernienzentren, in der die frühen postoperativen Ergebnisse von insgesamt 90 robotischen und 79 offenen Transversus-abdominis-release -Operationen verglichen wurden [37]. Es wurde festgestellt, dass die Dauer des postoperativen Krankenhausaufenthalts in der robotischen Gruppe signifikant kürzer war (3,4 vs. 6,9 Tage). In der offenen Gruppe traten schwerwiegende Komplikationen (20,3 % vs. 7,8 %) und Wundkomplikationen signifikant häufiger auf (12,7 % vs. 3,3 %).