Das Pankreaskarzinom stellt in Europa die vierthäufigste Krebstodesursache dar und wird im Jahr 2030 voraussichtlich auf Platz 2 der Krebsmortalität liegen [1]. Die einzige potenziell kurative Therapieoption ist die chirurgische Resektion, mit der weiterhin kaum eine 5-Jahres-Überlebensrate von lediglich 10 % erreicht wird [2]. Die aggressive Tumorbiologie führte in den letzten 10 Jahren zur Einführung neuer effektiverer chemotherapeutischer Therapieregime, sowohl adjuvant als neoadjuvant, was zur Etablierung multinodaler Therapiekonzepte führte.
Operationsindikation
Auf Initiative der Deutschen Gesellschaft für Allgemein- und Viszeralchirurgie (DGAV) wurden evidenzbasierte Empfehlungen zur Operationsindikation des Pankreaskarzinoms definiert, wobei die Indikation durch ein Tumorboard von erfahrenen Pankreaschirurgen leitliniengerecht unter Berücksichtigung individueller Patientenbesonderheiten gestellt werden soll [3]. Nach den Empfehlungen, die auf der systematischen Analyse von 58 Originalarbeiten und 10 Leitlinien basieren, besteht eine Operationsindikation bei histologisch nachgewiesenem Pankreaskarzinom als auch bei hochgradigem Verdacht auf ein resektables Pankreaskarzinom [3, 4].
Resektabilität
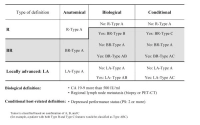
Die größte Überlebenswahrscheinlichkeit besteht bei der Resektion im Gesunden, der R0-Resektion [5, 6]. In den aktuellen Leitlinien wird nun die R0-Klassifikation unterteilt in „R0 narrow“ (≤ 1 mm) und „R0 wide“ (> 1 mm), wenn das Karzinom weniger bzw. mehr als einen Millimeter an den Resektionsrand heranreicht [7]. Zusätzlich zur anatomischen Resektabilität (Lagebeziehung zwischen Tumor und großen Viszeralgefäßen) wurden seit 2017 die Tumorbiologie und der Allgemeinzustand des Patienten als mitentscheidende Resektabilitätskriterien berücksichtigt und als ABC-Konsensus-Klassifikation der Resektabilität in die aktuellen S3-Leitlinien aufgenommen [8].
ABC-Kriterien der Resektabilität gemäß dem International Association of Pancreatology (IAP) Konsensus
(Zum Vergrößern bitte anklicken)
Quelle: Isaji S et al (2018) International consensus on definition and criteria of borderline resectable pancreatic ductal adenocarcinoma 2017. Pancreatology18(1):2–11.
Zur Beurteilung der anatomischen Resektabilität empfehlen die S3-Leitlinien eine kontrastmittelverstärkte 2-phasige Computertomographie [7]. Anhand der anatomischen Resektabilitätskriterien lässt sich ein Tumor in primär resektabel, grenzwertig resektabel („borderline resectable“) und nicht resektabel bzw. lokal fortgeschritten einteilen [7].
Die Einschätzung der biologischen Resektabilität erfolgt am häufigsten anhand des Tumormarkers CA 19-9. Der Grenzwert wurde mit > 500 IU/ml definiert, da ab diesem Wert eine Resektabilität in nur unter 70 % der Fälle gegeben und ein Überleben von unter 20 Monaten zu erwarten ist. [8, 9].
Als weiteres Kriterium wird der ECOG-Performance-Status als konditionale Resektabilität herangezogen, wobei Patienten mit einem Status ≥ 2 eine schlechte Prognose haben [8].
Mesopankreas
Das Mesopankreas, die Bindegewebsregion um die großen Gefäße der Pankreasregion, welche dicht von Blut- und Lymphgefäßen sowie von Nervengeflechten durchzogen ist, wird seit einigen Jahren diskutiert [10]. Metaanalysen deuten darauf hin, dass die totale mesopankreatische Resektion onkologisch bessere Ergebnisse ermöglicht [11]. Bei der Pankreaskopfresektion erfolgt die vollständige Entfernung des mesopankreatischen Gewebes zwischen Pfortader, Leberarterie, Basis des Truncus coeliacus und A. mesenterica superior (Triangle-Operation [12, 13]), bei Pankreaslinksresektionen (Corpus-, Schwanzkarzinome) die radikale antegrade modulare Pankreatosplenektomie (RAMPS [14]).
[RAMPS: Hier wird je nach Tumorausdehnung ein anteriores von einem posterioren RAMPS-Verfahren unterschieden, bei denen im Wesentlichen radikaler nach dorsal reseziert wird. Beim anterioren RAMPS erfolgt die Resektion unter Mitnahme der Gerota‘schen Faszie und des perirenalen Fettes auf der linken Seite. Dagegen erfolgt beim posterioren RAMPS zusätzlich zur Gerota’schen Faszie und des perirenalen Fettes die Resektion der linken Nebenniere.]
Gefäßresektion
Bei venösen Resektionen in Zentren sind Morbidität und Mortalität minimal erhöht und ein adäquates Gesamtüberleben wird ermöglicht [15, 16]. So kann nach den aktuellen S3-Leitlinien eine Gefäßresektion der Vena portae bei einer Tumorinfiltration ≤ 180° oder auch bei komplexen Situationen wie einer kavernösen Transformation mit Rekonstruktion erfolgen [17]. Arterielle Resektionen hingegen sind sehr riskant, oft komplex und benötigen nicht selten gleichzeitig auch venöse Rekonstruktionen. Die Patienten profitieren onkologisch häufig nicht von den ausgedehnten Eingriffen und zeigen nicht selten schlechtere Überlebensdaten als Pateinten ohne Gefäßresektion [18]. Von arteriellen Resektionen sollte daher außerhalb von Zentren abgesehen werden.
Unerwartete Arterienresektionen lassen sich vermeiden, indem bei einer kurativ intendierten Pankreasresektion die Tumorfreiheit der A. mesenterica superior und des Truncus coeliacus durch eine frühzeitige Freilegung überprüft wird. Die „Artery-first“-Strategie hilft, frustrane Eingriffe zu vermeiden, ermöglicht eine bessere Planung von Gefäßresektionen und -rekonstruktionen und verbessert in Zentren mit entsprechender Expertise das Langzeitüberleben für ausgewählte Patienten [19].
Oligometastasierung
Der Begriff Oligometastasierung taucht erstmals in den aktuellen S3-Leitlinien auf und beschreibt das Vorliegen von ≤ 3 Metastasen, die nur innerhalb von Studien im Rahmen eines multimodalen Behandlungskonzepts reseziert werden sollen [7]. Es liegen bisher keine randomisierten Studien vor, die Resektion von Oligometastasen scheint aber die Überlebensdaten der Patienten im Vergleich zu einer palliativen Chemotherapie zu verbessern, insbesondere nach einer neoadjuvanten Therapie [20 - 23]. In Deutschland beschäftigen sich aktuell die HOLIPANC- und METAPANC-Studie mit dem Thema [24].
Neoadjuvante Therapiekonzepte
Bei Patienten mit einem borderline-resektablem Pankreaskarzinom empfiehlt die aktuelle Leitlinie eine präoperative Chemotherapie oder Radiochemotherapie, bei resektablen Karzinomen soll sie nicht außerhalb von Studien stattfinden [7]. Die Empfehlungen beruhen auf den Daten einer Metaanalyse sowie aktuell veröffentlichten Studiendaten [25, 26]. Da nach neoadjuvanter Therapie die Resektabilität bei initial borderline-resektablen und lokal fortgeschrittenen Pankreaskarzinomen bildmorphologisch schwer beurteilbar ist, empfiehlt die Leitlinie bei stabiler Erkrankung zur Beurteilung einer sekundären Resektabilität eine chirurgische Exploration [7, 27]. Bei der Beurteilung einer sekundären Resektabilität kann auch der Abfall des CA 19-9-Wertes helfen [28. 29].
Laparoskopische Techniken und Robotik beim Pankreaskarzinom
Pankreaslinks- und Pankreaskopfresektionen müssen differenziert betrachtet werden. Für die Linksresektionen in laparoskopischer Technik zeigte die randomisiert-kontrollierte LEOPARD-Studie eine raschere Rekonvaleszenz, einen geringeren Blutverlust und keine höhere Komplikationsrate im Vergleich zur offenen Technik [30]. In der kombinierten Analyse der LEOPARD- und LAPOPS-Studie wurden die Daten bestätigt [31]. Die Langzeitlebensqualität bleibt durch die laparoskopische Technik unverändert [32]. Eine Metaanalyse der bisherigen Daten ergab vergleichbare Ergebnisse für die R0-Resektionsrate und die Rate adjuvanter Chemotherapie [33]. Das mediane Gesamtüberleben war mit 28 bzw. 31 Monaten für laparoskopische und offene Pankreaslinksresektionen gleich [34].
Für Pankreaskopfresektionen ergab die 2019 veröffentlichte randomisierte und kontrollierte LEOPARD-2-Studie eine höhere Mortalität (90-Tages-Mortalität 10 %) in der laparoskopischen Gruppe, die gegenüber der offenen Gruppe keine Vorteile hinsichtlich postoperativer Schmerzen, Rekonvaleszenz, stationärer Verweildauer und Lebensqualität aufwies [36]. Eine aktuelle chinesische randomisierte Studie ergab bei der laparoskopischen Pankreaskopfresektion eine vergleichbare Mortalität bei nur geringfügigem Vorteil der laparoskopischen Technik [37].
Die Robotik hat sich in den letzten 10 Jahren auch in der Pankreaschirurgie etabliert. So wird neben der technisch einfacheren Linksresektion zunehmend auch die Pankreatikoduodenektomie durchgeführt. Hier ist allerdings eine lange Lernkurve erforderlich [37] und eine abschließende Bewertung hinsichtlich onkologischer Ergebnisse bislang nicht möglich. Zum Einsatz der Robotik bei malignen Indikationen liegen lediglich Beobachtungsstudien vor, die die Machbarkeit belegen und potenzielle Vorteile der minimal-invasiven Technik zeigen [38, 39, 40]. Nach den internationalen Leitlinien stellt eine maligne Indikation keine grundsätzliche Kontraindikation für die Robotik dar, mit den Ergebnissen randomisiert kontrollierter Studien und damit hochwertigen Ergebnissen ist jedoch voraussichtlich erst in 3 bis 5 Jahren zu rechnen [41].
Zentralisierung der Pankreaschirurgie
In High-volume-Zentren für Pankreaschirurgie kann die postoperative Mortalität gesenkt und das Überleben erhöht werden [42, 43, 44]. Vor diesem Hintergrund werden nach Entscheidung des gemeinsamen Bundesausschusses in Deutschland die Mindestmengen für komplexe Pankreaseingriffe ab 2024 von aktuell 10 bis auf 20 Resektionen pro Jahr angehoben.
Whipple-Operation versus Pylorus-erhaltende Pankreatoduodenektomie (PPPD)
Zur Resektion von Pankreaskopf- und periampullären Karzinomen kommen zwei Operationsverfahren in Betracht, die klassische Resektion nach Kausch-Whipple und die Pylorus-erhaltende Pankreatoduodenektomie. Letztere hat den Vorteil der erhaltenen physiologischen Nahrungspassage und die Reduktion von Dumping-Syndromen, postoperativem Gewichtsverlust und Reflux [45-52].
Die aktuelleren Studien [49, 51, 52] konnten eine geringere Transfusionsrate und stationäre Verweildauer bei PPPD-Patienten im Vergleich zur Whipple-Gruppe zeigen. Die postoperative Morbidität unterschied sich nicht signifikant in beiden Gruppen. Das Auftreten von Magenentleerungsstörungen war in beiden Gruppen vergleichbar (Whipple 23 % vs. PPPD 22 %). Hinsichtlich der chirurgischen Radikalität fand sich ebenfalls kein signifikanter Unterscheid (R0-Whipple 82,6 % vs. R0-PPPD 73,6 %). Das Langzeit-Follow-up zeigte vergleichbare Gesamt-Überlebensraten.